(株)日本ベクトン・ディッキンソン(以下、日本BD) 本社:東京都港区、代表取締役社長:阿知波 達雄)は、遺伝子の抽出から検出までを全自動で行うPCR検査装置「BDマ ックス™全自動核酸抽出増幅検査システム(以下、BDマックス」専用の新型コロナウイルス検出試薬「BDマックス™ SARS CoV2」を2020年6月26日に研究用試薬として発売する。
本試薬キットは新型コロナウイルス 検出用の試薬として、米国では4月18日にアメリカ 食品医薬品局(FDA)の緊急使用許可(EUA Emergency Use Authorization)を取得し、既に販売されている。欧州では4月10日にCE IVD体外診断用医療機器指令を取得している。
新型コロナウイルス感染拡大防止の要となる、PCR検査(ポリメラーゼ連鎖反応の検査数の増加と迅速化が求められている。本試薬キットは遺伝子の抽出から検出までを全自動で行うPCR検査装置BD マックス)専用の試薬キットである。本装置との組み合わせにより 新型コロナウイルス遺伝子の抽出から、増幅、検出工程までを全自動で実施でき、検体を装置にセットしてから約2.5時間で24検体を同時に検査できる。本試薬キットは検査に必要な試薬類が予め分注されているプレフィルド方式であり、試薬の調製が不要で検体のコンタミネーション(汚染)のリスクやヒューマンエラーを防止するとともに、検査作業の効率 化と標準化および検査精度の均一化を図ることが期待される。
本試薬は、厚生労働省健康局結核感染症課及び国立感染症研究所による「臨床検体を用いた評価結果が取得された2019 nCoV遺伝子検査方法について」(2020年6月25日版)において、陽性一致率、及び陰性一致率ともに100として結果が公表され、公的医療保険の適用対象となっている(厚生労働省保険局医療課発事務連絡令和2年6月25日、疑義解釈資料の総送付について(その18))。
本試薬の提供により、日本国内の新型コロナウイルスの検査数の増加と迅速化に貢献できるものと考える。
製品の特徴: BD マックス™ SARS CoV 2
⚫ 検査の効率化:プレフィルド方式で試薬調製が不要
⚫ 検査の標準化:BDマックスでの全自動検査により検査を標準化し、コンタミネーション(汚染)のリスクやヒューマンエラーを防止
*本キットは研究用試薬である。医薬品医療機器等法に基づく体外診断用医薬品としての承認・認証等を受けていない。
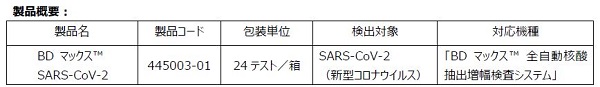
「BDマックス™全自動核酸抽出増幅検査システム」
BDマックスは、検体からは、検体から遺伝子遺伝子をを抽出してPCRで遺伝子を増幅し、検出するまでの工程をオートメーション化し、ワークフローの効率性を最大限に高めた全自動リアルタイムPCR検査装置だ。同時に24検体を検査することができ、最初の検査がPCRでの増幅工程に入れば、次のラックがセットできるため、初回ラックの測定開始から約1時間後に次のラックがセット可能となる。BDマックスは、新型コロナウイルスの検査において広く活用されており、米国、欧州、アジアを中心に数百台が導入されている。
販売名:BDマックス
製造販売届出番号:07B1X00003000125

●お問い合わせ
(株)日本ベクトン・ディッキンソン
URL:https://www.bdj.co.jp/

