オーバスネイチメディカル(株)(以下、オーバスネイチメディカル)は、2019年9月18日付で、「COMBOⓇ Plus コロナリーステント」(以下、COMBOⓇ Plus、抗体使用冠動脈ステント)の日本における製造販売承認を取得した。
COMBOⓇ Plusについて
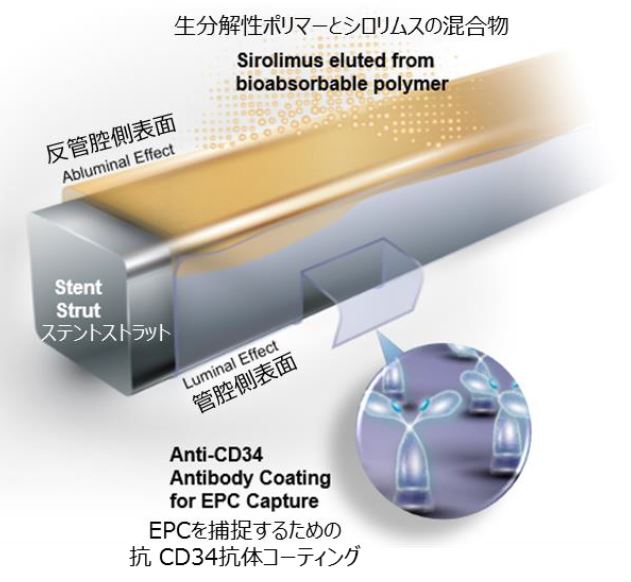
このCOMBOⓇ Plusは、冠動脈内腔を内側から押し広げて保持することを目的として冠動脈血管に経皮的に挿入するステントシステムであり、現在国内で販売されている薬剤溶出型ステント(drugelutingstent;DES)の3コンポーネント(金属製ストラット、薬剤、ポリマー)に加え、抗CD34抗体が使用されている。

COMBOⓇ Plusは、リコイル※1を防ぐ強いラディアルフォースと二重らせん構造による優れたコンフォーマビリティを兼ね備えたステンレス鋼製のステントを採用。
このステントの血管壁側ストラット表面には、国内で医療用医薬品としても使用されている免疫抑制剤シロリムスとその支持体(生分解性ポリマー)との混合マトリックス層がコーティングされている。
免疫抑制剤シロリムスは、ステント留置後に血管組織へ約30日にわたって徐放され、細胞増殖を阻害する薬剤溶出型ステントとして機能し、再狭窄を抑制する。生分解性ポリマーは、加水分解により約90日で消失する。
更に国内既承認DESでは初めて使用されることとなる抗CD34抗体がステントの全表面に固定されている。抗CD34抗体は、損傷した血管内皮の修復に関与する循環血中の血管内皮前駆細胞(endothelial progenitor cells;EPC)を捕獲する機能を有していることが報告されている。
COMBOⓇ Plusの使用に関し、現在までにこの抗CD34抗体に対するアレルギー等の有害事象は報告されていない。
国内臨床試験について
オーバスネイチメディカルは、COMBOⓇ Plusの承認を取得するために、HBD(Harmonization By Doing、日米医療機器規制調和)※2の枠組みに基づき、2014年2月より世界初となる日米共同治験『HARMONEE(Harmonized Assessment by Randomized, Multi-center Study of OrbusNEich’s COMBO StEnt)試験』を開始した。
この治験は、日本における冠動脈ステントの治験としては最大規模の登録症例数(日米両国で約600例、40施設以上)を誇るものであり、集積されたステント留置後1年経過時の安全性及び有効性の結果において、試験対照医療機器のエベロリムス溶出ステント(以下、EES)に対して非劣性であることが示された(p=0.020)。
さらに、ステント留置後1年経過時のステント内の健常な新生内膜組織被覆率において、EESに対し優越性が認められた。
COMBOⓇ Plusの開発の経緯について
製造元であるOrbusNeich Medical, Inc.(オーバスネイチメディカル社)は、1990年代にステンレススチールを素材としたDNA二重らせん構造から着想を得たストラットデザインのステントである『Rステント』を開発した。
『Rステント(本邦未承認)』は、強いラディアルフォースを維持しつつ長軸方向への柔軟性が高いという長所を有し、CEマークを取得している。
その後、2000年代にRステントのプラットフォーム表面に抗CD34抗体をコーティング(血中を循環する血管内皮前駆細胞(EPC)を抗CD34抗体が捕獲し、ステント内側の内皮細胞被覆を迅速に達成させる目的)した『Genous(本邦未承認)』を開発。
その後、ステント留置部の再狭窄を抑制するとともに、抗血小板療法への依存を軽減して安全な使用を可能にすることを目的に、Genousに薬剤コーティングを施すことで薬剤溶出ステント(DES)の機能を追加した『COMBO(本邦未承認)』を開発。
そしてさらに、『COMBO』のデリバリー性能を高めるために、ステントは同一であるが、デリバリーカテーテルを改良した『COMBO Plus(本製品)』が開発され、このほど国内にて承認を取得するに至った。
COMBOⓇ Plusは、世界50カ国以上で承認されており、現在も多くの患者に使用されている製品である。
※1 リコイルは、デバイスによって一度拡張された血管の内径が再び縮小する現象
※2 HBDは、主に心血管系の医療機器における日米の規制の整合化を図ることを目的とした、FDA(米食品医薬品局)と厚生労働省/PMDA(独立行政法人医薬品医療機器総合機構)を中心に日米両国の官・学・民が共同して行う活動の場。国際共同治験の推進や、日米間で協力して審査を実施する体制の構築、効率的かつ迅速な審査を進めるための施策の検討を行い、日本としては、医療機器承認のタイムラグの改善を目指している。
関連リンク:http://www.jfmda.gr.jp/hbd/index.html
●お問い合わせ
オーバスネイチメディカル株式会社 広報担当
TEL:03-5738-5750(代表)
e-Mail:info@orbusneich.jp
URL:

