ボストン・サイエンティフィック、アテローム切除アブレーション式血管形成術用カテーテル「ジェットストリーム アテレクトミー システム」を販売開始~重度石灰化病変に対する治療選択拡大への期待~
ボストン・サイエンティフィック ジャパン株式会社(本社:東京都中野区、代表取締役社長:森川智之)は、重症石灰化病変を有する下肢末梢動脈に用いるアテローム切除アブレーション式血管形成術用カテーテル「ジェットストリーム アテレクトミー システム(以下 JETSTREAM)」を2023年8月より順次販売を開始した。
本品は2021年10月26日に浅大腿動脈(SFA)および/または近位膝窩動脈(PPA)の重度石灰化病変(ステント内病変を除く)を対象とした国内初の回転式アテローム切除術システムとして薬事承認を取得、2022年9月に新区分(C1)にて保険収載された。その後、市販後調査期間に所定の症例数登録が完了し、販売に必要なすべての要件が満たされ、今回販売に至った。
末梢動脈疾患(PAD) は、動脈硬化による足や手の血管の閉塞を特徴とする病状で、世界中で約2億人の患者が罹患していると推定されている。*1治療には運動療法と薬物療法が含まれる。さらなる改善が必要な場合は、バルーン、および/またはバルーンカテーテル拡張またはステント留置が行われる。
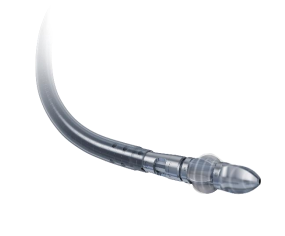
「JETSTREAM」は、浅大腿動脈及び/又は近位膝窩動脈において、重度石灰化病変を有し、薬剤塗布型バルーン治療の前拡張に使用する経皮的血管形成術用バルーンカテーテルが不通過又は拡張困難な病変(ステント内を除く)に対し、固いアテローム塊や狭窄病変を除去することで、前拡張を容易にする目的で使用される。
コンソールからの電気エネルギーにより、カテーテル先端部のディスタルカッター及びエクスパンダブルブレードを回転させ、病変部の切削及び破砕吸引を行う。
本製品は本邦初のアテレクトミーデバイスとなり(適応は上記)、重度石灰化病変などバルーン拡張等の治療を断念せざるを得なかった病変に対し、薬剤塗布型バルーン(DCB)と併用することで重度石灰化病変に対する血管内治療が可能となる。これによりボストン・サイエンティフィック ジャパン株式会社は下肢末梢血管治療用の製品として、エルビア薬剤溶出型末梢血管用ステント、レンジャー薬剤コーティングバルーンカテーテル、そしてJETSTREAMの主力3製品がそろった。PAD治療にさらなる選択肢をもたらし、市場への価値還元を行っていくことを目指している。
医療機器承認番号:30300BZX00287000
ボストン・サイエンティフィック ジャパン株式会社 代表取締役社長 森川智之は、「高齢化に伴い末梢血管疾患の患者さんが増加している中、本邦初のアテレクトミーデバイス(適応は上述)となるJETSTREAMの販売により、治療の選択肢が増えることで日本の医療に貢献できることを嬉しく思います。国内臨床試験を始め承認・販売に至るまでご尽力いただいた諸先生方に感謝の意を表すとともに、益々カテゴリーリーダーとして患者さんの健康に寄与できるよう努めてまいります。」と述べている。
本製品は日本心血管インターベンション治療学会・日本血管外科学会・日本インターベンショナルラジオロジー学会の3学会で策定された適正使用指針に準拠した使用が求められるデバイスである。
承認条件は以下となる
1.末梢閉塞性動脈疾患に対する血管内治療に関連する十分な知識及び経験を有する医師が、本品に関する技能や手技に伴う有害事象等の知識を十分に習得した上で、治療に係る体制が整った医療機関において本品を用いるよう、必要な措置を講ずること。
2.関連学会との協力により作成された適正使用指針の周知、講習の実施等、必要な措置を講ずること。
適正使用指針については関連学会のホームページをご参照のこと。
J-SUPREMEⅡ 臨床試験(国内臨床試験)の紹介
J-SUPREMEⅡ試験は日本人の浅大腿動脈及び/又は近位膝窩動脈の症候性閉塞性動脈硬化症患者(狭窄度70%以上で血管の両側に石灰化を有する重度石灰化病変を含む長さ150mm以下の狭窄性、再狭窄性又は閉塞性病変を有する)を対象とした前向き多施設共同単群臨床試験で、JETSTREAMアテレクトミーシステムの安全性及び有効性を評価する目的で実施された。
31例(平均年齢72.5±7.7歳、病変長122.6±55.6mm、石灰化PACSSグレード319.4%、グレード477.4%の患者が登録され、JETSTREAMによる切削後に薬剤コーティングバルーン(DCB)を併用し治療が行われた。臨床試験の結果、主要解析集団である PP(per-protocol)解析対象集団において、主要評価項目である治験手技時の病変成功率*2 は78.6%(22/28 例)であり、その97.5%片側信頼区間下限値の59.1%はあらかじめ設定した性能指標(PG)を上回り、主要評価を満たした。また、ITT(intent-to-treat)解析対象集団における治験手技時の病変成功率*2は、80.6%(25/31 例)を示した。
ITT解析対象集団において、手技成功率は100%(31/31 例)であり、手技中にベイルアウトステント留置又はバイパス術を必要とした症例は認められなかった。
手技後6ヶ月間を通して未知の有害事象は発現せず、重篤な有害事象(SAE)は9.7%(3/31 例)認められたが、すべての事象について医療機関より治験機器及び治験手技との因果関係なしと報告された。また、その他特筆すべき有害事象は認められなかった。
以上より、浅大腿動脈及び/又は近位膝窩動脈に位置する重度石灰化病変(閉塞病変を含む)を有する患者に対して、アテレクトミーデバイスとしての本品の安全性及び有効性が示された。
*1 : Fowkes FG, Rudan D, Rudan I, et al. Comparison of global estimates of prevalence and risk factors for peripheral artery disease in 2000 and 2010: A systematic review and analysis. Lancet 2013; 382: 1329–1340.
*2:病変成功はDCBによる拡張後に次の条件をすべて満たすことと定義した:i)標的病変の残存狭窄率が 30%以下である、ii)NHLBI(米国国立心臓肺血液研究所)の分類でタイプC以上の解離が発生していない、iii)治療を要する臨床的に明らかな血管穿孔が発生していない、iv)標的血管の血流が著しく低下し、閉塞性の合併症(リコイル等)が発生していない
ボストン・サイエンティフィックについて
ボストン・サイエンティフィックは世界中の患者の健康を向上させる革新的なメディカルソリューションにより生活を改善している。40年超、グローバルな医療テクノロジーのリーダーとして、患者の満たされていないニーズに対応し、ヘルスケアのコストを削減するパフォーマンスの高い広範なソリューションを提供して、生活のためのテクノロジーを発展させている。日本においては、心血管疾患領域をはじめ、不整脈・心不全疾患領域、末梢血管疾患、消化器疾患、泌尿器疾患、婦人科疾患領域、疼痛管理・パーキンソン病の治療領域で、患者の人生を実り多いものにすることに全力で取り組み、日本の医療に意義のあるイノベーションを起こしていく。
企業サイト:https://www.bostonscientific.jp
お問い合わせ先
ボストン・サイエンティフィック ジャパン株式会
コーポレートコミュニケーションズ&ブランディング部
TEL:080-7557-2172、090-9132-5785
Email: pressroom@bsci.com

