-
記事を探す
- COMPANY メーカー情報
- PRODUCT 製品情報
- NEWS FLASH 取材速報
- NEWS お知らせ
- REPORT 学会レポート
- INTERVIEW インタビュー
- SPECIAL スペシャルレポート
- MAIL MAGAZINE メール配信
-
メディカルウォッチについて
- 会社案内
- 採用情報
- 個人情報保護方針
- 特定商取引法に基づく表記
- お問い合わせ
Copyright 2021 Medical Eye, All rights reserved.
記事を検索

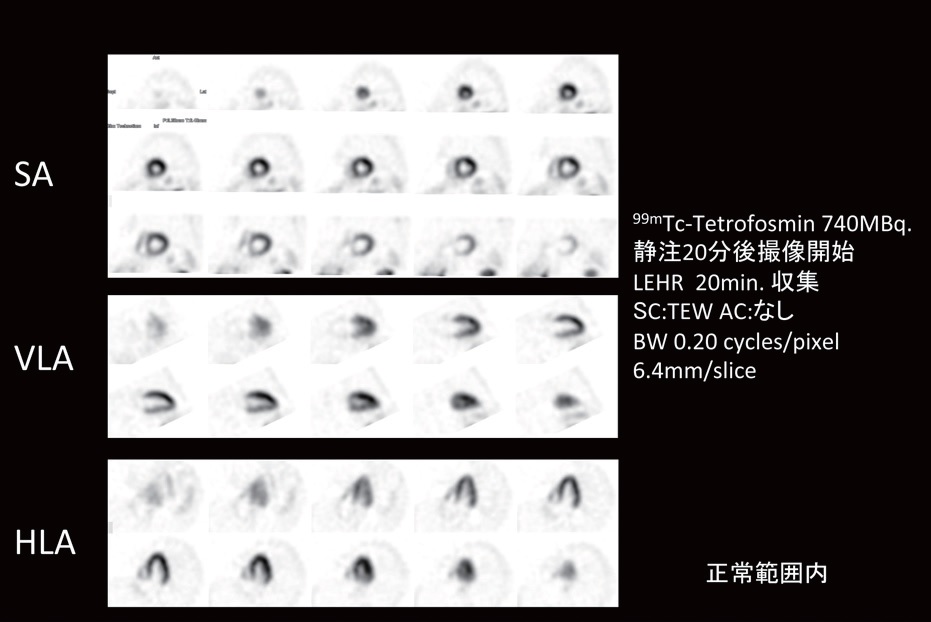
 マークのある画像は、クリックすると画像が拡大されます。
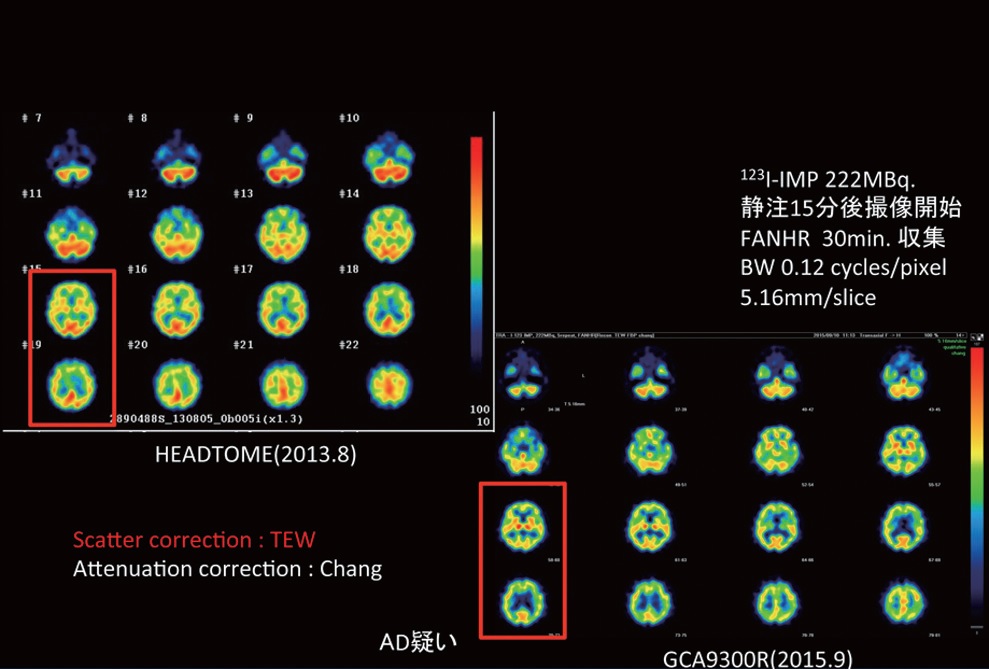
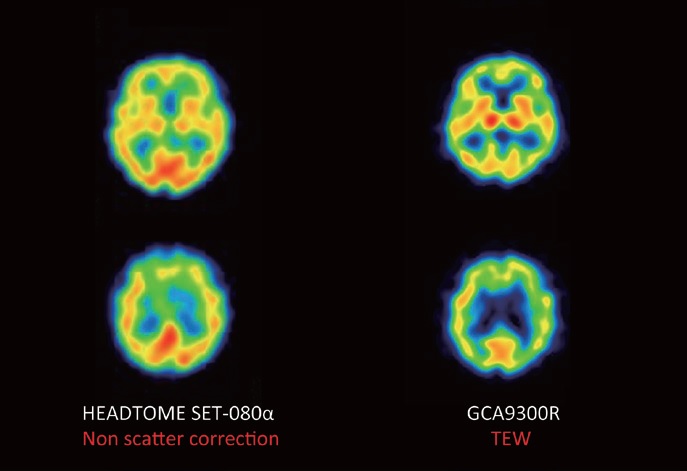
マークのある画像は、クリックすると画像が拡大されます。

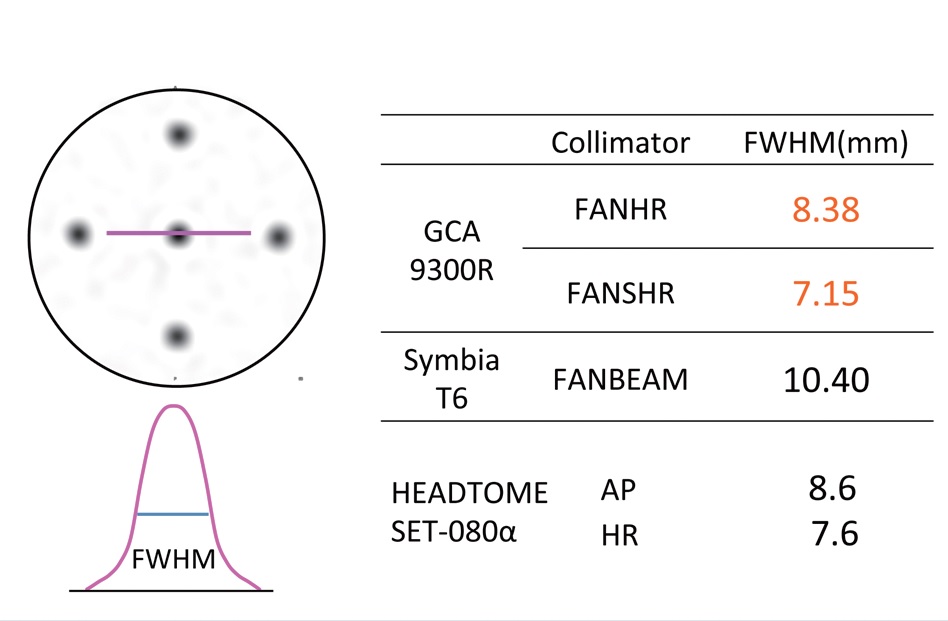
 図1 SPECT分解能の比較結果
図1 SPECT分解能の比較結果