第67回日本消化器画像診断研究会イブニングセミナー
病理からみた膵病変─どこから発生し、どのように進展していくのか─
日時:2017年9月15日
場所:札幌プリンスホテル国際館バミール
共催:東芝メディカルシステムズ株式会社
司会
手稲渓仁会病院消化器病センター
真口宏介先生
講演1 腫瘍
東北大学大学院医学系研究科病理形態学分野
古川 徹先生
膵管内腫瘍は膵癌の前駆病変として知られている。腫瘍細胞の分化形態により、Lowgradeの腫瘍は臨床的な問題につながることが少ない一方で、High-gradeの腫瘍は上皮内癌相当であり、やがて浸潤・転移をきたし予後不良に経過すると考えられている。本講演では、膵管内腫瘍の中でも多く見られる膵管内乳頭粘液性腫瘍(IPMN)を中心に、最新の病理学的分類や特徴、および臨床との関連について解説する。
はじめに
膵癌の前駆病変は、膵管内腫瘍が繰り返し生じているという状態とほぼ同じであるということはコンセンサスとなっている。膵管内腫瘍の代表的なものとして、膵上皮内腫瘍性病変(PanIN)、膵管内乳頭粘液性腫瘍(IPMN)、膵管内管状乳頭腫瘍(ITPN)が知られている。IPMNは、粘液を入れた膵管拡張を主徴とし、拡張膵管内に乳頭状の腫瘍性上皮の増生を見る。腫瘍細胞は種々の分化形態、異型度を示し、進行すると浸潤転移をきたし予後不良に経過する。そのような特徴を有するIPMNであるが、グレード分類、亜型分類の意義、断端の取扱い、PanINとの鑑別、浸潤癌の由来と評価、微小浸潤の評価、あるいは類似病変など病理学上の問題点も少なからずある。
KEY SENTENCE
●膵管内腫瘍(PanINおよびIPMN)は2段階に分類される
●IPMNのサブタイプ分類により予後は異なる
●IPMNの断端評価ではHigh-grade dysplasiaあるいは浸潤癌の見極めが重要
IPMNのグレード分類
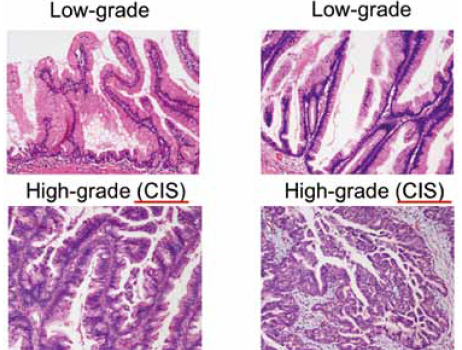
従来のIPMNのグレード分類は、Low-grade(adenoma)、Intermediate grade(borderline)、High-grade(noninvasive carcinoma)という3段階の分類となっていた。その後、症例が蓄積されるにしたがって、IPMNの多くはcysticな病変でありLow-gradeからIntermediate gradeのものが比較的多く、それらが臨床的に問題となることはほとんどないという報告がなされるようになってきた。そしてBaltimore Consensus MeetingやVerona Consensus Meetingにおいて議論された結果、現在ではPanINおよびIPMNはLow-gradeとHigh-gradeの2段階に分類することが推奨されている(図1)。加えて、Baltimore Consensusでは、High-gradeのPanINおよびIPMNはcarcinoma in situと同義であるということが国際的に確認された。
2017年に発行された膵癌取扱い規約でも、従来からadenoma、non-invasive carcinoma、invasive carcinomaと3段階に分けられていたが、WHO分類あるいはBaltimore Consensusとほぼ同様の認識となった。膵管内乳頭粘液性腺腫は、Low-grade、あるいはintermediate grade をまとめたものとなっている。Non-invasive carcinomaはHigh-gradeに相当し、WHO分類との対比もしやすいところで現在のコンセンサスになっている。
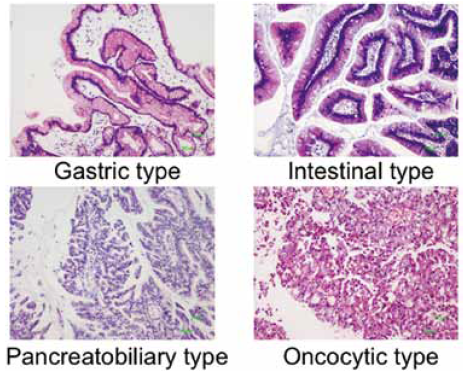
IPMNの4つのサブタイプ
最近になってIPMNの4つのサブタイプ分類(図2)も国際コンセンサスとして認識されるようになった。これは、われわれが2005年に報告した論文1)が元になっており、gastric、intestinal、pancreatobiliary(PB)、oncocytic というサブタイプがMUCの発現とよく相関することが知られてきている。臨床的意義については、われわれがまとめた国内のデータでは、gastric、intestinal、oncocytic、PBというサブタイプが予後とよく相関することが分かった2)。たとえばgastricはLow-gradeが多いため予後は良好であるのに対してPBは全例High-gradeであり、
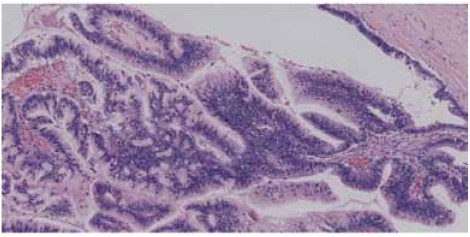
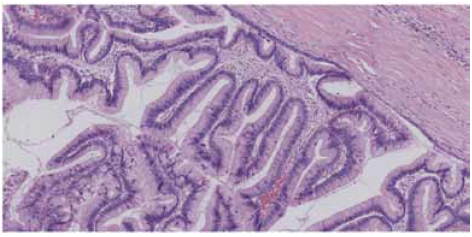
invasionを伴うことも多いことから予後が悪い。そしてIntestinal、oncocyticはそれらの中間にあたることをクリアに示すことができたため、このサブタイプの重要性が認識されるようになっている。 実際の症例を見ると、図3は大きな膵管内に非常に強く増生しているintestinal IPMNで、極性の乱れも強い悪性所見であり、一見してHigh-gradeだということが分かる。
図3 Intestinal type IPMN, High-gradeの組織像
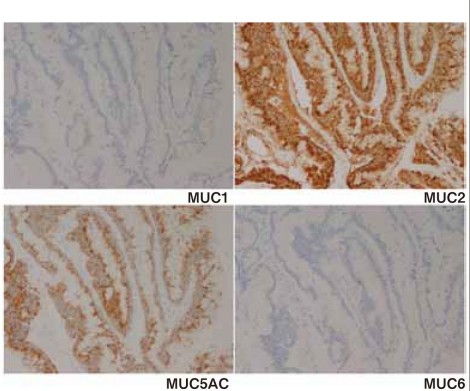
図4に示すように免疫染色ではMUC2とMUC5ACが陽性となり、典型例といえる。
図4 Intestinal type IPMN, High-gradeの免疫染色像
図5は、膵管の中に強く上皮が増生しているが、極性がある程度保たれており、上皮の増生にある程度規則性が見える。これは従来、intermediate gradeと分類されていたものであるが、最新の分類ではLow-gradeになる。
図5 Intestinal type IPMN, Low-gradeの組織像
Oncocytic type IPMN(図6a)は、ややまれなタイプであるが、好酸性の上皮が葉状に広がったような形で乳頭が構築され一つ一つが積み重なって分岐するような像となり、核の形も特徴的である。
Oncocytic type IPMNではMUC5とMUC6の両者が染まることが典型的で、MUC1、MUC2は何れかが染まり、一様ではないことが特徴といえる(図6b)。Oncocytic type IPMNにはバリエーションがあるが、乳頭の形は不整でHigh-gradeに相当する。
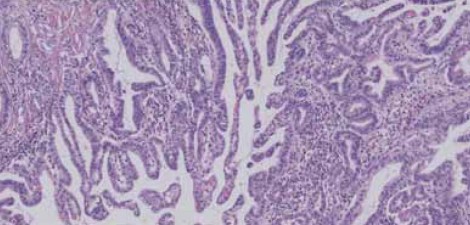
図7 Pancreatobiliary type IPMNの組織像
Pancreatobiliary(PB)type IPMNは非常に複雑な乳頭状の増生を呈する。図7に示したのは典型的な例で、浸潤を伴っているパターンである。PBの特徴はMUC1の発現が見られることで、PB typeとoncocytic typeは典型的なものを比べると鑑別は容易であるが、時として鑑別が難しいものがある。
分子異常を調べてみると、PB typeはoncocytic typeに比較してKRAS変異やSMAD4欠失、TP53過剰発現などが多い傾向が見られる。Invasion featureについては、PB typeは浸潤すると通常型のductal carcinomaとほぼ似たようなパターンが認められるが、oncocytic typeでは管内成分とほぼ同様のものがそのままクラスター状に間質の中に浸潤し、oncocytic carcinomaと呼ばれる。時として分かりにくいものもあるが、このような特徴をとらえて診断していくことが重要になる。
PanINおよびIPMNの鑑別
Non-invasive IPMNの断端について検討された報告がいくつかある。Low-gradeの103例について解析した日本のデータでは、断端陰性例は断端陽性例と比較して予後が良好だったことが示されている3)。5 % のHigh-gradeを含む192例について検討したSloan-Ketteringがんセンターのデータでも、断端陽性例は経時的に再発が見られ、断端陰性例は断端陽性例と比較して予後が良好だったことが示されている4)。合計565例のメタ解析5)では、断端陰性の症例では再発率は3.7%であった一方で、断端陽性の場合には再発率が9.5%と有意差が見られるものの、全生存率にはあまり影響が見られないということが現在までのコンセンサスになっている。IPMNの断端評価にあたっては、High-grade dysplasiaあるいは浸潤がんをしっかり見極めることが重要である。そしてHigh-grade dysplasiaが断端にあれば、追加切除するのが望ましいと考えられる。いずれにしても、断端の状態にかかわらず残膵のフォローアップをすることが大事である。
PanINとIPMNの境界をどこに設定するかについては、現在のところ実際的な基準として5mm以下の拡張病変はPanINで、10mm以上の拡張病変はIPMNであるとされている。そうすると、たとえば7mmの場合はどちらに分類されるのかという問題が生じる。その場合に手掛かりとなるのは組織像と分子異常の違いである。PanINの多くはgastric typeの上皮が小型膵管の中に増殖してくる一様なパターンである一方、IPMNは非常にバリエーションに富んでいるのが大きな特徴である。また微小な初期病変として、incidentIPMNという概念があり、小規模な膵管拡張の中に乳頭状の上皮増生が連続的に広がっているものはIPMNと考えられる。分子異常については遺伝子変異の有無がポイントで、IPMNの半数以上にGNAS遺伝子変異があるが、PanINにはGNAS変異はないことが知られている。われわれのモデルマウスを用いた検討では、変異GNASはMUC発現を誘導し、IPMN発生の必要条件であることを示唆するデータが得られている6、7)。
IPMNと浸潤癌の関連
IPMNと浸潤癌の関連については、IPMN由来浸潤癌とIPMN併存浸潤癌をどのように区別するかということが問題になっている。組織学的に連続性のあるものはIPMN由来浸潤癌と言えるが、そうでないものをどう考えるかという問題が残る。ただ、IPMN由来浸潤癌あるいはIPMN併存浸潤癌の何れでもIPMNを伴った癌は通常型に比べて予後が良好であると結論されている論文がある8)。浸潤癌への移行に関しては、図8に示したoncocytic type IPMNの症例では、管内の病変から間質に浸潤する病変が連続している。一部、管腔が壊れており、その中に浮遊するような癌細胞のクラスターがあることから粘液癌になるパターンである。微小浸潤については以前から取扱い規約に記載されており、現在はT分類を浸潤部の大きさで分け、0.5cm未満をT1a、0.5~1.0cmをT1b、1.0~2.0cmをT1cと分類するようになっている。たとえば図9に示した管内病変を有するIPMNの症例では、非常に小さな上皮細胞のクラスターが間質の中に潜り込んでいて、粘液を漏らしながら浸潤しているように見える。サイズは0.5cmよりも小さいためT1aという分類になる。このようなものから、IPMN由来浸潤癌がつくられていくと考えられる。
まとめ
2012年にヨーロッパの研究グループから発表された論文では、PanINに典型的な乳頭状の病変ではなく、フラットなままで異型が強くなり、周りに同心円状の線維化をきたすような病変が見られると報
告されている。これはあくまでマウスモデルでのデータで、ヒトでの報告はあまりない。今後、このようなものがヒトにおいてどの程度認められるのか、あるいはそれが癌のprecursorとしてどのような病
態につながっていくかについて検討していく必要がある。
<文献>
1) Furukawa T et al: Classification of types of intraductal papillary-mucinous neoplasm of the pancreas: a consensus study. Virchows Arch 447: 794-799, 2005
2) Furukawa T et al: Prognostic relevance of morphological types of intraductal papillary mucinous neoplasms of the pancreas. Gut 60: 509-516, 2011
3) Fujii et al: Prognostic impact of pancreatic margin status in the intraductal papillary mucinous neoplasms of the pancreas. Surgery 148: 285-290, 2010
4) Frankel et al: Dysplasia at the surgical margin is associated with recurrence after resection of non-invasive intraductal papillary mucinous neoplasms. HPB 15: 814-821, 2013
5) Leng et al: Impact of pancreatic margin status and lymph node metastases on recurrence after resection for invasive and noninvasive intraductal papillary mucinous neoplasms of the pancreas: a meta-analysis. Dig Surg 29: 213-225, 2012
6) Komatsu et al: A GNAS mutation found in pancreatic intraductal papillary mucinous neoplasms induces drastic alterations of gene expression profiles with upregulation of mucin genes. Plos One 9: e87875, 2014
7) Taki et al: GNAS(R201H) and Kras(G12D) cooperate to promote murine pancreatic tumorigenesis recapitulating human intraductal papillary mucinous neoplasm. Oncogene 35:
2407-2412, 2016
8) Yamaguchi et al: Pancreatic ductal adenocarcinoma derived from IPMN and pancreatic ductal adenocarcinoma concomitant with IPMN. Pancreas 40: 571-580, 2011
9) 古川 徹:膵管内乳頭粘液性腫瘍(IPMN)由来癌vs通常型膵癌vs併存癌, 鬼島 宏ほか;腫瘍病理鑑別診断アトラス 胆道癌・膵癌.文光堂,225-229,2015
講演2 炎症
膵炎においては、組織分類が不完全であり、またclinicoradiological pathological
correlationが難しい状況でありながら組織診断が求められる場合が少なくない。膵炎の床的経過の中で、病理組織を観察できる機会は多くはないが、本講演ではAcinar-ductal metaplasia(ADM)や線維化など膵炎の病理学的特徴から病態形成プロセスについて考察した。
はじめに
膵炎においては、病理学的な理解が難しい点がいくつか存在する。まず組織分類が不完全で、疾患概念が急性膵炎、慢性膵炎、自己免疫性膵炎ぐらいしかなく、また循環障害も膵炎に包括されているのが実状である。そして、clinicoradiological pathological conferenceが非常に難しいにもかかわらず組織診断が重要な局面が出てくる。特に2型自己免疫性膵炎では組織診断が必須であるが、対峙すべき疾患の病理が詳しく分からない状況で病理医は診断をしなければいけないという難しさがある。
急性膵炎や慢性膵炎における時間経過の中で、通常、病理医が組織を観察することができるのは、重症急性膵炎の剖検例または慢性膵炎患者で何らかの理由で死亡した患者の剖検例などに限られる。1型自己免疫性膵炎だけは診断時に組織を観察することが可能な特殊な病態で、軽症急性膵炎は全く組織を見る機会がないといってもよい。したがって、病理医は入手可能な組織から、どのようなプロセスでこのような結果になったのかを推測しなければいけない。
KEY SENTENCE
●炎症性疾患を考える際は常に正常組織との比較が重要
●Acinar-ductal metaplasia(ADM)は腺房細胞が再生を開始する現象である可能性がある
●1型自己免疫性膵炎の線維化は独特で、必ずしも実質障害を反映したものではない
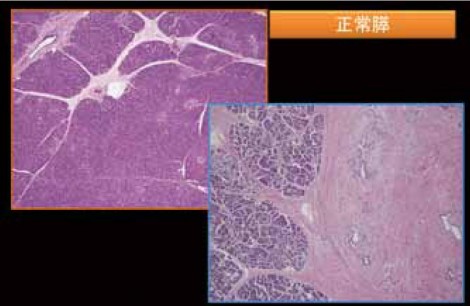
正常組織から何が消失したのかを考える
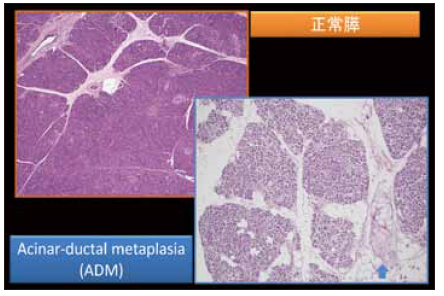
まず、膵炎がどのように始まるのかについて推測し、そして慢性膵炎と1型自己免疫性膵炎の進展についても推測してみたい。剖検症例において、図1に示すような脂肪組織の小さな壊死を見ることがある。巣状の脂肪壊死、あるいは巣状膵炎というような名称で剖検報告書に記載されることが多いと思われる。強拡大にすると、小葉の中に小さい腺管がたくさんできていて、Acinar-ductal metaplasia(ADM)であることが分かるが、ここにみられる所見はそれだけでよいのかという疑問が残る。
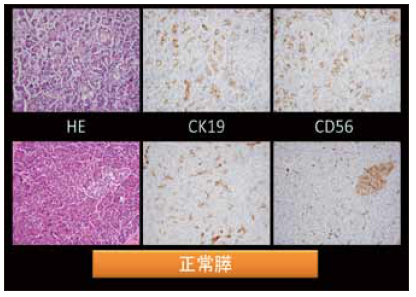
炎症性疾患を考える際は、常に正常組織との比較が重要である。この場合、正常膵と比較して剖検膵において消失したものは何かということを考える。実際に見てみると、ADMの組織では腺房細胞がかなり減っていることが分かる(図1)。正常膵では腺房細胞がぎっしり詰まっていて、小葉はきれいな紫色に染まるが、ADMの小葉では紫の色調が失われている。トリプシンの免疫染色をすると、正常膵では腺房細胞が陽性になるが、ADMでは陽性細胞が減少していることが分かる。
この現象に興味を持って免疫染色法を用いて検討したところ、ADMの小さな腺管が膵管のマーカであるサイトケラチン19で陽性に染色された(図2)。正常膵においてサイトケラチン19陽性を示すcentroacinar cellなどの存在を差し引いても数が増加していることが分かる。また、CD56の免疫染色において、正常膵ではラ氏島や神経などが陽性になるが、ADMの腺管も陽性になることが分かった。さらにCD56を染色することにより、ADMが決してまれなものではないことが示唆され、われわれが検討した約100例の剖検例のほぼ半数では多かれ少なかれこの変化が起こっていた。トリプシンとCD56の二重染色をすると、トリプシン陽性の腺房細胞とCD56陽性の細胞が移行して検出される。本来centroacinar cellがあると思われるところに陽性細胞が出てきて、これがだんだん腺管様の構造になっていくことが観察される。
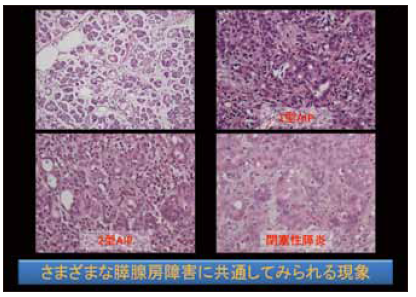
ADMは、剖検の膵臓でのみ確認されるものではない。図3に示すように、たとえば1型自己免疫性膵炎や2型自己免疫性膵炎の小葉内病変にもADMが認められ、閉塞性膵炎でもADMが見られるため、決して疾患特異性があるわけではない。ADMは、さまざまな膵臓の腺房障害に共通して見られる現象だと言えるかもしれないが、背景にある炎症細胞の種類などを見ることによって、鑑別診断はある程度可能だと考えられる。
興味深いこととして、自己免疫性膵炎患者の生検を同一患者で繰り返し実施した研究において、ステロイド治療前の組織像では腺房細胞が失われて小葉の中にADMの所見が認められるが、治療後の組織像では腺房細胞が再生するという現象が観察されている。また、通常は腺房細胞の細胞膜が陽性に染まるアクアポリン1について調べると、自己免疫性膵炎患者の治療前の組織では細胞質まで陽性に染まり、ステロイド治療後には正常な膜表面の局在が復活してくる、つまり膵臓の機能が回復したことを示唆する所見が得られている。したがって、ADMは腺房細胞が再生を開始する現象をとらえている可能性がある。
2型自己免疫性膵炎における病理学的特徴
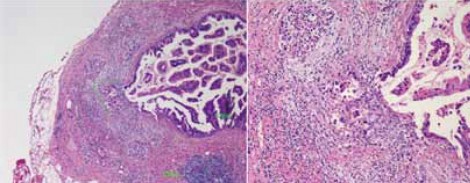
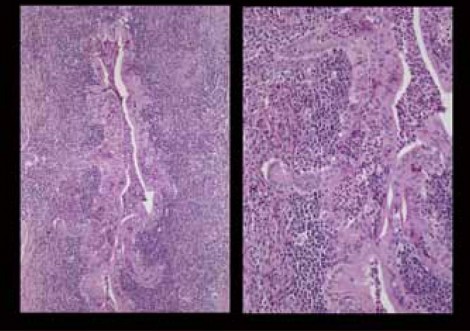
2型自己免疫性膵炎は、外分泌膵(膵管・小葉)を中心とする炎症性の病変である。膵管に高度な炎症細胞の浸潤が起こり、それと連続するように小葉の中にも高度な炎症細胞浸潤が見られる。膵管の病変が非常に特徴的で、図4に示すような膵管の上皮あるいは内腔に好中球が多く浸潤してくるgranulocytic epithelial lesion(GEL)という所見が診断に役立つ。
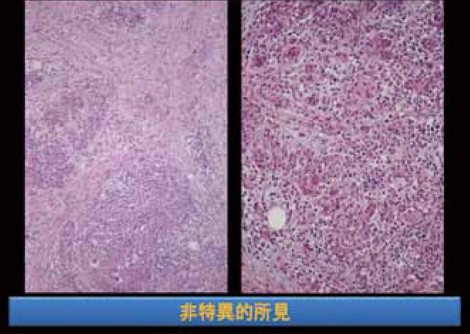
ICDC(International Consensus Diagnostic Criteria)における2型自己免疫性膵炎の診断基準では、GELの存在は診断に大きく寄与する所見であると見なされているが、腺房(小葉内)への好中球浸潤自体は特異的ではないと考えられている(図5)。ところが、現在のようにEUS-FNAで診断しようということになってくると、腺房内への好中球浸潤をもって診断をするしかない。果たしてこれは妥当な診断方法なのか、検証が必要である。2型自己免疫性膵炎の小葉内にはADMがあって好中球やリンパ球、形質細胞の浸潤が起こるという特徴があるが、薬剤性膵炎においても非常によく似た像を示すことがあり、鑑別の難しかった症例も経験している。
ADMが比較的軽度の膵障害で起こるのに対して、重症急性膵炎の際に起こる変化は強い壊死である。重症急性膵炎による壊死は、CT perfusionを用いて血流が減少している部位を確認することにより壊死を早期に診断することができる。壊死を起こした部位は、いわゆる創傷治癒のプロセスをたどると考えられる。すなわち、大きな組織の欠損が起こるとそこに肉芽組織が形成され、やがて瘢痕組織になる。ただ、そのようなプロセスで形成された瘢痕組織と慢性膵炎の病変は、おそらくその形態を見ただけでは鑑別が難しいだろう。
慢性膵炎における病理学的特徴
慢性膵炎の経過に関しても、正常膵を念頭において、まず失われている構造は何かということを考えていく。たとえば小葉間に線維化が認められる場合、その場所に本来何があったのかということである。図6に示す慢性膵炎の病理組織では小葉間膵管と小葉間膵管の距離が大きく開いて見える。つまりこの場所にはもともと多くの小葉があったことが推測され、小葉が破壊されて線維化に置換された像であると解釈できる。また、一つの小葉の中に筋状に線維化が入ってくるような像もある。これはおそらく強い組織障害が起こり、比較的膵臓の組織が残っている部分では再生が起こるものの、組織が残っていない部分は線維化になったものを見ていると推測できる。進行した慢性膵炎は膵硬変と呼ばれることもある。これは、線維化が起こる一方で、残った膵組織が再生することによって結節状になるものを指すと考えられるが、実際の剖検などでは慢性膵炎はむしろ組織荒廃が強く線維化がメインの所見であることが多い。
2007年にKloppelが慢性膵炎の発症プロセスの仮説を報告している。そこでは、最初は主に脂肪組織の炎症があり、それから膵臓の中に壊死が起こり、線維化が進行してくることによって膵管が狭窄する。その結果、膵液の貯留が起こり、膵全体に線維化が広がっていくのが慢性膵炎の経過だと記載されている。実際に、小葉間に非常に強い線維化があり、小葉間にあった脂肪組織が線維化したと推測される像を見ることがある。図7に示すような組織像は、膵の脂肪浸潤あるいは脂肪置換と呼ばれるが、このような症例に慢性膵炎が起こると膵実質が脱落して線維化で置換されてくるだけでなく、脂肪組織が障害され線維化によって置換されていくことも重要なプロセスになると考えられる。
1型自己免疫性膵炎における病理学的特徴
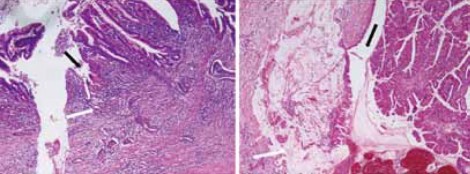
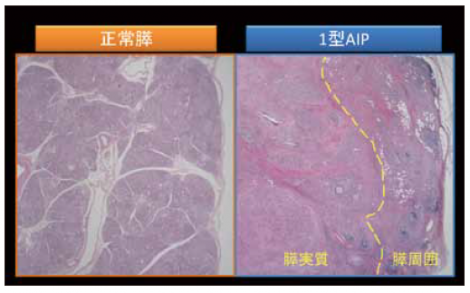
1型自己免疫性膵炎の組織は非常に不思議なもので、線維化を特徴としながら膵腫大が見られる。通常、線維化が進行すると臓器は萎縮を呈するにもかかわらずである。また、線維化を呈する割に臓器障害が乏しく炎症のターゲットが何であるのか、よく分からない。正常膵と1型自己免疫性膵炎の弱拡大像を比較すると、図8のように1型自己免疫性膵炎は膵実質と膵周囲の病変からなる。膵周囲の病変は本来脂肪組織があったところである。膵実質では小葉構造がきれいに保たれており、膵臓の辺縁のところに同じような厚さの炎症巣が膵臓を取り巻くように形成されるのが特徴である。後者はCT画像におけるcapsule-like rimに相当する(図9)。
正常な膵臓の小葉間には血管が入ってくる非常にルースな結合組織が存在するが、その部分に線維化が入り込んできてcapsule-like rimに相当する炎症巣と連続し、膵全体が線維化で固められたのが自己免疫性膵炎の膵組織であるといえる。それゆえに図10のようなソーセージ様の形態になっていくと考えられる。 1型自己免疫性膵炎において特徴的な変化の一つに花莚状線維化がある。花莚状線維化の定義については、炎症細胞浸潤と小型紡錘形細胞からなり、花莚状の錯綜配列を示し、さまざまな程度の線維化を伴う病変と考えている。細胞成分が豊富であることが、花莚状線維化と診断する上では重要である。これはいうならば、lymphohistiocytic proliferative disorderというような変化で、これが1型自己免疫性膵炎の本態ではないのかと推測している。
1型自己免疫性膵炎では膵周囲の脂肪細胞が減少しているため、脂肪組織の障害が存在すると考えられる。そして、小葉の中ではADMが形成されていることから、腺房細胞も障害されていると推測されるが、その変化は軽微で可塑性のあるものと考えられる。ただ実際には、萎縮が生じるような症例も存在する。それに関しては、膵管病変の形態の違いで決まってくる可能性があると考えている。膵管の上皮周囲に壁のような炎症性の病変(Cuffing lesion) が生じた症例と生じていないNoncuffing lesionの症例について、それぞれ小葉内病変について観察すると、Cuffing lesionを構成する5例のうち3例が著明な組織破壊、2例が著明な炎症細胞浸潤、Noncuffing lesionであった14症例はすべて比較的軽度の細胞浸潤のみであった。Cuffing lesionとNon-cuffing lesionの違いは、花莚状線維化の炎症パターンの有無であり、それが小葉における変化の違いとして現れる。一つの可能性として、Cuffing lesionが存在すると、膵管の狭窄が非常に強くなることを意味するのかもしれない。またこのような強い炎症がある場合には、小葉の中にも非常に強い炎症があり、萎縮例では小葉が完全に破壊された痕を見ているという解釈も可能だろう。
まとめ
まず炎症性病変の組織像を考えるときには消失した構造を認識するということが重要である。ADMは軽症の膵腺房障害を示唆する所見であると推測される。また慢性膵炎の線維化は、膵実質障害と脂肪浸潤の炎症の両方が線維化したものと考えられる。1型自己免疫性膵炎における線維化は独特で必ずしも実質障害を反映したものではなく、実質障害はむしろ軽度であるという点でユニークである。