PETサマーセミナー 2017 in 奈良 ランチョンセミナー3 整形外科領域におけるPET/CT検査
人工関節からのアーチファクトとその低減技術
日時:2017年8月26日
場所:ホテル日航奈良
共催:東芝メディカルシステムズ株式会社
整形外科領域において、PET検査は骨肉腫や軟部腫瘍の診断、骨転移の評価などに用いられる。本講演では、診療放射線技師の立場から、整形外科領域のPET検査の特徴を述べ、特に問題となる人工関節からの金属アーチファクトについて、その要因と低減技術について説明する。
KEY SENTENCE
●受診者の動作制限によるトランケーションアーチファクトを防ぐためFOV内に被写体をおさめることが重要。
●金属アーチファクトの低減のためには、それぞれのアーチファクトの機序により最適な画像処理方法を選択することが大切である。
●人工関節の金属アーチファクト低減にはSEMARが有用。併せて、受診者の体動抑制も重要である。
整形外科領域におけるPET検査の特徴
整形外科領域におけるPET検査の役割を考えてみると、当院では骨肉腫や軟部腫瘍の診断に対する検査依頼が多くあった。また、骨転移の評価に対しても骨シンチおよびFDGPET検査が行われている。また、研究においては、関節リウマチ患者の治療効果評価、感染性脊椎炎、脊椎感染症の診断、または人工関節周囲感染の診断や大腿骨頭壊死症の診断にPETが用いられている。使用薬剤は主にFDGであるが、骨領域のため、NaFも比較的多く使われている。
図1 PET/CT Imaging Artifacts
1.ポジショニングとFOV
整形外科領域の場合、腫瘍が関節に発生すると、受診者の動作に制限が生じる。よって検査体位が制限され、伸展が困難な場合や、屈曲位で固定が必要な場合もある。また撮像に関しては、骨/軟部組織関連疾患などの上・下肢に存在するFOVの端にある病変を描出したり、対称性を観察するため患側と健側の両方を描出することもある。このとき、通常のFOVサイズの装置で撮像すると、目的部位が視野中心にないため、撮像が困難な症例もある。当院では、患者の抑制方法の工夫を行ったり、ラージボアタイプの装置で撮像するなどの対策をしている。
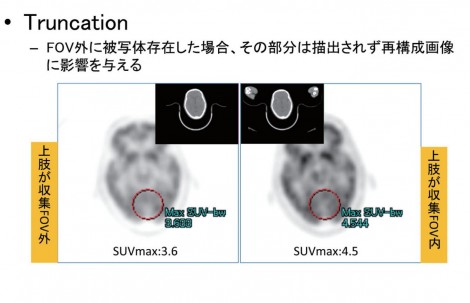
FOV外に被写体が存在すると、トランケーションエラーによりアーチファクトが生じ、FOV外の描出できなかった部分が画像再構成に影響を与える。図1は頭部領域撮像において両上肢を挙上させ、上肢がFOV外に出た症例。SUVを比較すると上肢がFOV外にある場合は3.6、FOV内の場合は4.5であり、差がみられる。トランケーションエラーが原因で、SUVは大きく変動するため、FOV内に被写体をおさめることは重要である。
2.受診者の年齢層
当院の過去のデータを見直してみると、受診者の年齢が比較的低いということが読み取れてきた。若い受診者の場合には、CTの被ばく線量をより考慮する必要がある。逐次近似応用再構成が導入できる装置であれば十分被ばく低減が可能であるが、導入していない装置で検査する場合もある。当院では逐次近似応用再構成であるAIDR 3Dを用いることで、CTDIが24.8mGyから6.8mGyに抑えられ、約1/4までの被ばく線量低減が実現できた。整形外科領域、特に若い受診者の場合には意識すべきだ。
3.体内金属
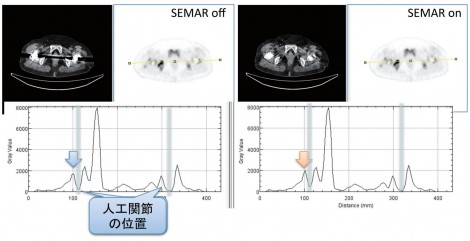
人工関節等の体内金属のある受診者が多いため、金属アーチファクトも問題となる(図2)。金属アーチファクトは減弱補正マップに影響を与えるため、SUVの変動要因となる。対策としては外部線源を用いた減弱補正を行うPET装置を使用するということが挙げられるが、これはハード面で難しい場合もある。よって、金属アーチファクト低減技術を導入することで、CT画像上の金属アーチファクトを抑制することが可能となる。
金属アーチファクト
一般的なPET/CT装置のデータフローは、CT画像を作成した後、CT画像をμマップ(減弱補正マップ)に変換し、ACF(Attenuation Correction Factor)を算出、これをPETデータに適用してPET画像を得るという流れであり、CT撮影の際に金属によるアーチファクトが発生すると、PET画像にも影響を与える。CT値と減弱係数の変換については、CT画像から得られるCT値(HU)を511keVの減弱係数に変換し、その後PET画像のマトリクスサイズに変換、分解能を調整してμマップを作成する。このためCT画像上に金属が存在すると、その影響を受けたμマップが作成されてしまう。質量減弱係数は、CT撮影のエネルギーと511keVの消滅放射線とで大きく異なり、これを補正する必要がある。CT撮影に対して消滅放射線はエネルギーが大きいため比較的減弱されにくい。
CT画像で金属アーチファクトがどのように観察されるか述べる。楕円形の被写体に縦に細長い金属が中央部に1つ存在すると、上下方向に金属アーチファクトが発生し、細い金属が少々膨らんでみられる。一方で、円形であれば横方向にアーチファクトがみられ、複数個の場合は、それぞれ線を引くような形でアーチファクトが存在する。金属の形やサイズなどによって、金属アーチファクトの様子も変わってくるため、金属アーチファクトの補正が難しいことがわかる。
また、金属アーチファクトの一要因として、ビームハードニング効果がある。低keV側の光子がより強く減弱するため、高keV側にエネルギーの分布がシフトする現象で、511keVの消滅放射線はビームハードニングが起こりにくい。金属アーチファクトは、複数の要因により発生しており(図3)、1つ目はスライス厚に依存するパーシャルボリューム効果。厚いスライスになるほど強くみられるため、スライス厚をできるだけ薄く設定することが、金属アーチファクトの低減において重要である。2つ目は、局所的なX線パルスでフォトン不足により発生するストリークアーチファクトであり、統計学的ノイズモデルを考慮した画像再構成の利用が有用で、逐次近似応用再構成であるAIDR 3D等を用いることでアーチファクトが低減できる。3つ目は、線質硬化によるビームハードニングアーチファクト。Dual Energy Scanの利用で、被ばくは少々増加するが、アーチファクトの改善が期待できる。4つ目は、ダークバンドアーチファクトといい、検出フォトンの大幅な減少や欠落により発生する。例えば減弱の強い金属等が大きなサイズで存在するとき、金属部分周辺の情報量がなくなる。人工関節等で特にみられ、これらを改善するには、投影と逆投影を繰り返し選択的に低減させる画像再構成が有用。これがSEMARである。
PET/CT検査において金属アーチファクトが発生した場合の対応としては、まずは従来通り減弱補正を行わないNon-AC画像を使って視覚的に評価を行うということが考えられる。Non-AC画像ではSUVを評価することができないので減弱補正を行ったAC画像との対比が必要である。また、外部線源を用いた減弱補正が可能な装置であればこれを用いたり、Dual Energy ScanやSEMARが可能な装置であればこれをCT画像に適用することによってμマップが補正されるということも可能である。メーカによっては減弱係数の上限値を設定することも可能なのでこの設定を最適化することによっても金属アーチファクトを低減することが可能である。
SEMARを用いた人工関節からのアーチファクト低減
SEMARを用いた人工関節からのアーチファクト低減について検討したので報告する。SEMAR はSingle Energy Metal ArtifactReductionの頭文字である。SEMARはオリジナルの生データからBack Projectionを行い、金属部分を抽出した後にForward Projectionを行うことで金属成分を除去した生データを得る。この生データを再度Back Projectionするという処理を複数回繰り返すことで金属アーチファクトを低減する。
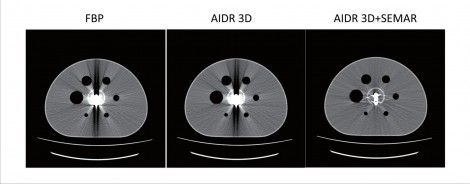
ファントムでSEMARによる金属アーチファクト低減の効果を示す(図4)。
図4 各補正方法による違い a FBP b AIDR 4D c AIDR 3D+SEMAR(a|b|c)
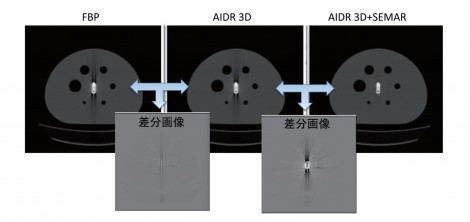
NEMAのBodyファントムの中心部分に人工関節を配置し、中心部分も外側(バックグラウンド部分)と同じ濃度のFDG溶液を満たした。CT画像をみてみるとFBPでは予想通り金属アーチファクトが発生した。AIDR 3Dのみの場合、視覚的にはアーチファクト低減効果が低いようにみえるが、加えてSEMARを使用することで、金属の輪郭までしっかり追えるようになり、画像が改善していることがわかる。しかし、金属アーチファクトを完全に含まない画像を得ることも難しいともいえる。μマップへの影響についても考える。AIDR 3Dでは、少々低減されているものの上下方向のアーチファクトがみられる(図5)。
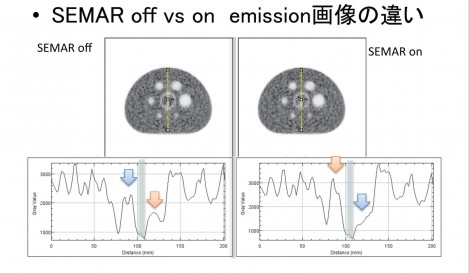
一方で、SEMARを加えるとアーチファクトが低減されている。サブトラクションをして差分画像を比較しても一目瞭然であった。また、金属の周辺部分に注目すると、金属の大きさにも変化がみられ、差が生じていた。PET画像への影響をみてみると視覚的にはあまり差がないようにみえる。PET画像への影響は減弱補正だけでなく散乱線補正などの他の要因も関連するためCT画像やμマップまでの顕著な差が生じないものと思われた。プロファイルカーブを描いてみると、SEMARを用いない場合には金属部周辺で高値または低値となり、一定ではない様々なアーチファクトが確認された(図6)。
金田先生の論文では、金属アーチファクトは常に生じるわけではないことが示されている1)。ファントム実験によってファントムの移動が擬陽性を生じることが示されており、受診者の動きによっても擬陽性を生じるということが分かる。
臨床データではSEMARを利用することでCT画像の改善が期待できる。これは、恐らく術中ナビゲーション用のデータとしても、有用だと考えられる。
図7は人工関節を両側に挿入している症例で、横軸方向にプロファイルカーブを取ってみると、SEMARを利用したほうに高いピークが確認できる。臨床では、金属の配置や動き、散乱線など様々な要因が影響し、Emission画像に影響するため、SUVが不安定になり、差分画像でも、金属周辺部分に強く差が生じていることが確認できる。
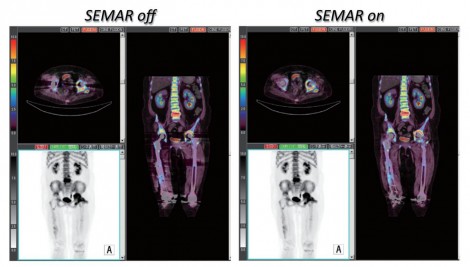
人工関節周囲感染においては、人工関節周辺部分のSUV値が重要であり、SEMARによる金属アーチファクト低減は有用な方法の1つである。図8でも、SEMARを利用することで人工関節周辺の集積が変化していることが分かる。今後、整形外科領域のPET検査においては金属部周辺のSUV安定性の担保にも留意して検討を進めていく必要があると考えている。
最後に
整形外科領域のPET検査において、骨関連疾患の描出には撮像時の対策が必要であり、アーチファクトの低減が求められる。CT撮影において金属アーチファクトには複数の要因が影響するため、アーチファクトの低減には最適な低減技術の選択が必要である。また、人工関節からの金属アーチファクトの低減にはSEMARが有用だが、それに加えて受診者の体動抑制も併せて行うことが重要となる。
<文献>
1)Tomohiro Kaneta et al:Nuclear Medicine Communications 28:495-499,2007
第52回日本胆道学会学術集会ランチョンセミナー6
運動器疾患における18F-Fluoride PETの有用性~整形外科医の視点から~
本講演では、整形外科の受診者がPET検査を行うとどのような画像となるか、またそれをどのように治療に生かすかという観点から、人工関節周囲感染(PJI)と無菌性ゆるみの鑑別、そして初期変形性股関節症(OA)の診断と病期進行予測、最後に股関節外科の最近のトピックスである大腿骨寛骨臼インピンジメント(FAI)における局所集積の意義について述べる。
はじめに~PETに何を求めるか
私たち整形外科医は、X線では分からないような異常が生じているのかどうかの判断、またその異常がどの程度なのかの定量評価、そして「なぜ痛いのか?」といった臨床評価との関連や治療法選択の指標となることをPET画像に求めている。近年PET技術の向上に伴い、さまざまな面で優位点を示す18F-Fluoride PETは新たな骨イメージングとして注目されている。
KEY SENTENCE
●18F-Fluoride PETは、画像診断として特異的なものがないとされている人工関節周囲感染と無菌性ゆるみの鑑別に有用である。
●初期変形性関節症の診断と病期進行予測に18F-Fluoride PETを用いることは、治療法選択の客観的評価として有意義である。
●FAIにおいてCam病変の位置情報とそれがactiveかどうかの指標として18F-Fluoride PET/CTが有用である。
人工関節周囲感染(PJI )
PJIは、人工股関節置換術(THA)や人工膝関節置換術後(TKA)におけるインプラント周囲感染で、人工関節置換術後の1%前後の確率で発症する。診断そのものに難渋することが多く、無菌性ゆるみとの鑑別が重要であり、画像診断として特異的なものはないとされている。
人工股関節の場合、骨頭部分にはコバルトクロムというCT画像上で非常に強いアーチファクトを生じる金属が使われているため、人工関節周囲が大きく抜けたような画像となる。
THAを対象とした検査ではアーチファクトを生じるため今日紹介されたようなアーチファクト低減技術は非常に有用だと感じている。
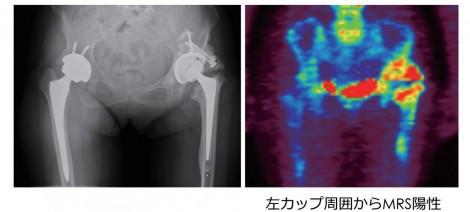
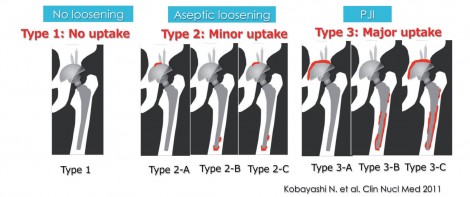
図1は両足THA症例。左カップ周囲からMRS陽性が出てきたが、右側の集積はほとんど認めない。感染のない人工関節の周りには術後半年までは手術の影響で強い集積が見られるが、1年過ぎると集積は認められないことが多い。しかし感染を起こすと非常に強い集積が生じる。
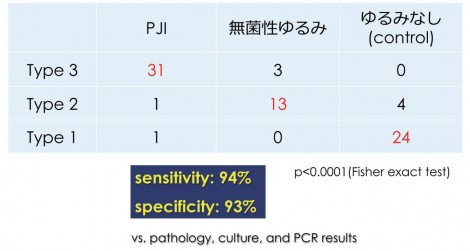
集積パターン分類を作成し(図2)、集積がないものをType 1、微小な集積をType 2、非常に広範に集積を示すものをType 3とし、Type 3がPJIなのではないかという仮説を立てた。症例を集めたところやはりType 3でPJIが非常に多く(図3)、Type 2では無菌性ゆるみ、Type 1ではゆるみなしが多かった。
図2 集積パターン分類(THA後)(文献1より引用)
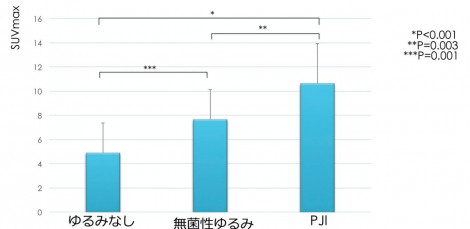
感度は94%、特異度が93%で、今までのFDG-PETを使った論文と比べても遜色のない診断能が示された1)。SUVmaxによる定量評価というのは重要で(図4)、比較するとPJIに非常に強い集積を認め、無菌性ゆるみはゆるみなしと比べると少し高値という結果となる。
確定診断のためには組織サンプルを採取する必要があるが、集積のある箇所から採取を行うことで細菌培養や病理組織の陽性率が上がるといった有用性もある2)。
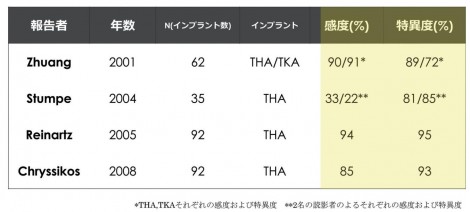
FDG-PETとの比較だが、FDG-PETでも感染部位に集積を認めるが、ただ、軟部組織、関節周囲に集積されるのが特徴的である。比べて18F-Fluoride PETは骨に集積されるので、インプラントの表面に集積されるという違いが出る。一般的にはPJIの診断ではFDG-PETがこれまでに研究されており、良好な診断能が報告されている(図5)。
なぜこのFluorideが感染で集積するのかを考察すると、PJIの起因菌となるStaphylococcusは骨芽細胞内に感染し、さらに細胞内で増殖するということが報告されているので3)、機械的ゆるみそのものよりも感染による骨芽細胞の活性上昇を捉えていると推測している。
初期変形性股関節症(以下OA)の診断と病期進行予測4)
前股関節症では関節裂隙の狭小化は認めず、初期OAでも若干狭くなる程度である。これに対して進行期または末期では関節裂隙の狭小化が鮮明で、誰が見てもOAであると指摘される。このような患者には一般的にはTHAが勧められ、PET検査を敢えて行う必要性はないが、初期または前股関節症においてはPET検査の存在意義が出てくる(図6)。
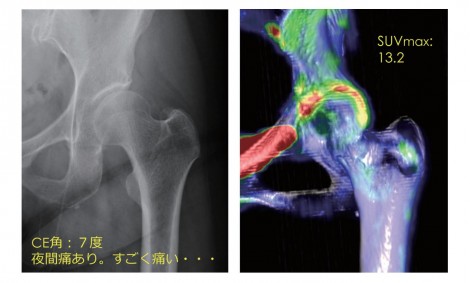
図7 症例 55歳女性左寛骨臼形成不全 前股関節症
初期または前股関節症の治療では、寛骨臼回転骨切り術を行うか、このまま経過観察するとOAは進行するか、はたまたTHAを行うか、そもそも本当に痛いのか、X線では判断できず整形外科医は迷うところである。次に実際に症例をあげたい。
図7は、55歳女性、左寛骨臼形成不全を認め前~初期股関節症である。関節裂隙はまだ保たれている。夜間痛を強く訴え、CE角が7°で、寛骨臼形成不全は明らかであり、骨切り術の適応がある。ただし、年齢が55歳と骨切り術を行うにはやや高齢である。そこでPETを施行したところ寛骨臼縁に非常に強い集積を認める。これはこのまま観察するとOAが進んで、関節裂隙は確実に狭くなるので、私たちはこの段階で、寛骨臼回転骨切り術をすすめ、患者も人工関節置換術と十分比較検討して骨切り術を選択した。術後1年だが、疼痛は改善し、OAの進行は認めていない。
寛骨臼回転骨切り術は侵襲を伴いリハビリや入院期間など患者負担の大きい手術なので、このような手術を施行するか否かの決定に際する客観的評価として18F-Fluoride PET検査は有用と考える。また患者側にとってもPET画像は異常部位が明瞭に認識でき、手術の必要性を理解する上で客観的指標となる。
OA進行の予測
我々は、このOA進行の予測について研究してきた。OA進行群と非進行群でSUVmaxを比較すると、OA進行群が有意に高い。また、疼痛悪化群と非悪化群で比較しても疼痛悪化群が有意に高値となる。痛みが強い症例はSUVmaxが非常に高いが、初期にSUVmaxが高値である場合は疼痛が悪化してくることを示しており、これは関節裂隙の狭小化とともに疼痛が悪化するためと考えられる。
この関節裂隙の狭小化におけるロジスティック回帰分析を行ったところ、性別、年齢、BMIは一般的に重要だとされているが、この中ではPETのSUV maxが唯一有意差を認め、非常に高い危険率でOAが進行するということが分かった。
どれくらいSUVmaxが高いとリスクが上昇するかについてROC解析を行ってみると、OA進行については、SUV max cut off値:6.5で感度:90%、特異度:84%、X線上の関節裂隙狭小化1mm以上の場合にはSUVmaxのcut off値は7.2となった。これらの結果からSUVmaxが6から7を超える場合にはOAが進行してくる確率が非常に高いということが分かった。
寛骨臼形成不全でOAが発症しやすい理由はそこに力学的ストレスが集中しているからであるが、有限要素解析という手法を用いて力学的ストレスとPETでの集積の関係を調べると見事に相関することが分かった5)。局所に強い力が加わると骨芽細胞が活性化しPETの集積は上昇するものと考えられる。
大腿骨寛骨臼インピンジメント(FAI )における局所集積の意義
FAIは比較的近年提唱された概念であり、スポーツ選手などに多い。一般に若い患者が多く、OA変化は生じていないためX線では判断が難しい場合も多い。
インピンジメントというのは骨と骨がぶつかりあう状態のことで、過度にぶつかることにより、間にある関節唇や軟骨がダメージを受ける。 特徴的な所見としては、X線ではCam変形と言われる微妙な出っ張りがある。これはFAIを専門的に見ていると分かるが、一般的にはあまり大きな所見ではないとされる場合も多い。また、肢位によっても見え方が大きく異なるため、X線のみでは評価が難しい場合がある。
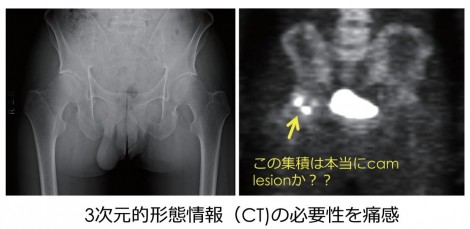
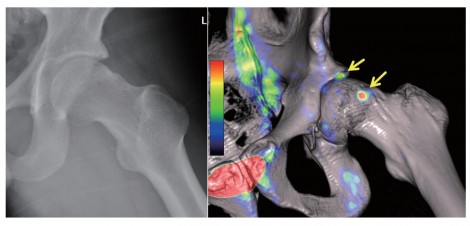
図86)はPET/CTが導入される前のPET単独の画像で、矢印部分に集積を認めCamtypeFAIと考えるが、この集積は本当にCam変形かがわかりづらい。解剖学的にこれがCam病変と一致することを、第三者が納得するよう客観的に示すことは難しく三次元的形態情報(CT)の必要性を痛感した。
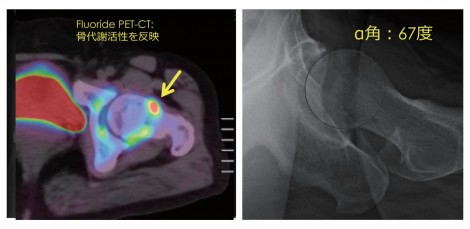
図9は、22歳男性のブレイクダンサーである。X線画像上でも分かりやすくCam変形が描出されている。PET/CT画像上ではCam変形とほぼ一致する位置に強い集積が認められる。これを見れば一般的な整形外科医でもFAIでありCam変形に伴う集積であると納得してもらえる画像であり、PET/CTの画像診断としてのインパクトを実感した症例である。
図9 22歳 男性 Cam-type FAIブレイクダンサー
図10 症例 42歳女性 Cam-type FAI(境界型寛骨臼形成不全合併)(a|b)
18F-Fluoride PETでFAIを診断する意義
FAIにおいてPETでCam病変があるか否か、その部位はどこか、そしてそのCam病変は現在activeかどうかということを知りたい。というのは、X線では形態的にCam変形を有していても、無症候性がすごく多いからだ。そして、手術でCam病変を切除するべきか否か、まで判断したい。
図10は42歳女性、Cam-type FAI(境界型寛骨臼形成不全合併)。関節裂隙狭小化を認めるが、X線の側面では骨の突出、すなわちCam変形を認める(図10b)。非常に強い痛みを認めたため、18F-FluoridePETで撮像すると矢印部分に高集積が認められる。寛骨臼形成不全はあるが、Cam病変も病態の大きな要素ではないかと推測できる。関節鏡視下手術で、最初に滑膜切除を行い、次に関節唇を縫合して、PETで赤い集積を認めたCam病変部の骨軟骨形成を行った。骨軟骨形成を行うかどうかで手術の時間が倍ぐらいになり、技術的にも非常に難しいためその判断は重要である。18F-Fluoride PET集積を全く認めず、X線的にも所見が乏しい場合にはCamの切除をあまり積極的に行わない方針としている。
まとめ
以上述べてきたように、18F-Fluoride PETは人工関節周囲感染や初期OA、FAIをはじめ大腿骨頭壊死症、RA、軟骨下脆弱性骨折、骨髄炎にも有用である。今後、非常に多くの骨関節疾患に応用できる可能性がある。
X線検査では診断できなくても、局所の骨代謝異常や痛いという症状の客観的評価・定量評価に使え、病期進行の予測や治療オプションの選択、骨代謝亢進を捉えることによる病態解明のアプローチに発展の余地があると考えている。
<文献>
1) Kobayashi N et al: Use of F-18 fluoride PET to differentiate septic from aseptic loosening in total
hip arthroplasty patients. Clin Nucl Med. 36(11): e156-161, 2011
2) Choe H et al: (18)F-fluorodeoxy glucose and (18)F fluoride PET for detection of inflammation
focus in periprosthetic hip joint infection cases. Mod Rheumatol. 25(2): 322-324, 2015
3) Mohamed W et al: Intracellular proliferation of S. aureus in osteoblasts and effects of rifampicin
and gentamicin on S. aureus intracellular proliferation and survival. Eur Cell Mater 28: 258-268,
2014
4) Kobayashi N et al: Use of 18F-fluoride positron emission tomography as a predictor of the hip
osteoarthritis progression. Mod Rheumatol. 25(6): 925-30, 2015
5) Hirata Y et al: Correlation between mechanical stress by finite element analysis and 18F-fluoride
PET uptake in hip osteoarthritis patients. J Orthop Res. 33(1): 78-83, 2015
6) Kobayashi N et al: Evaluation of local bone turnover in painful hip by 18F-fluoride positron
emission tomography. Nucl Med Commun. 37(4): 399-405, 2016