第55回日本核医学会学術総会
第35回日本核医学技術学会総会学術大会
神経変性疾患の診断─Parkinson病、Parkinson症候群
日時:2015年11月6日
場所:ハイアットリージェンシー東京
共催:東芝メディカルシステムズ株式会社
座長
鳥取大学医学部病態解析医学講座画像診断治療学分野
小川敏英 先生
鳥取大学医学部脳神経医科学講座脳神経内科学分野
中島健二 先生
Parkinson病は運動症状に基づいて臨床診断がなされているが、症状が多岐に渡り、病理診断と一致しない例が少なくないことが問題となっている。典型的な所見をとらない症例や、ドパミン異常の確認できない症例をどう解釈するか、また最近注目を浴びている前駆症状はどうとらえればよいか、Alzheimer型認知症や進行性核上性麻痺などの他の神経変性疾患との鑑別はどうするかなどについて、臨床症状および心筋シンチグラフィやドパミントランスポーターシンチグラフィといった画像を交えて、Parkinson病、および関連疾患の診断例を紹介する。
【KEY Sentence】
●Parkinson病は様々な症状を呈することから臨床診断での課題が多い。
●家族性Parkinson病PARK2ではMIBGシンチの取組みは多くの症例で正常。
●ドパミン異常が認められないSWEDDsや運動障害発症前の前駆症状が注目されている。
●レム期睡眠行動異常はParkinson病の前駆症状として考えられる。
●Parkinson病と進行性核上性麻痺の鑑別が重要。
●画像診断の進歩により病理学的変化を正確にとらえることに期待。
Parkinson病の診断基準の問題点
Parkinson病(PD) は、1817年にロンドンの開業医James Parkinsonが『An Essay onthe Shaking Palsy』1)という著書で紹介したのが最初で、1888年にフランスのCharcot教授が、同書を臨床講義で紹介し、以後、PDという疾患概念が確立した。Parkinson氏が記載した特徴は、振戦などの運動症状であり、知覚、知能は正常と記載されている。
PDは運動症状を基に診断されてきており、非運動症状はほとんど無視されていた。しかし最近、嗅覚、急性低血圧、便秘等の自律神経障害、睡眠障害、レム期睡眠行動異常症(RBD)、認知症等の非運動症状が非常に注目されてきている。
PDは、様々な症状を呈することから、臨床診断には課題が多いといわれる。
EFNS(欧州神経学会連合)とMDS(国際Parkinson病・運動障害疾患学会)が2013年に出した診断基準2)の推奨とMDS臨床診断基準3)でも、臨床症状に基づいているが、診断確定の補助的なものとして嗅覚障害、神経画像検査を挙げており、今後はこれらが発症前診断にも重要になってくるとしている。
現在、臨床診断の基準で国際的に最もよく使われているのが、1988年に出されたイギリスのブレイン・バンクによる診断基準4)である。寡動 (bradykinesia)症状があり、筋強剛や振戦、姿勢反射障害が少なくとも1つあるのが条件で、除外診断と支持診断により判定する。前述のMDSによるガイドライン2)におけるこの診断基準のレコメンデーションはレベルBとされている。
臨床診断での問題は、無動・筋強剛・安静時振戦のうち2項目が当てはまっても、そのうちの25%は病理学的にPDではなく、逆に病理学的にPDである症例の25%は臨床的に診断されていない点である5)。近年の報告でも、PDの病理診断66例中の58例(88%)しか、臨床的にPDと診断されておらず、臨床診断でPDとされた77例中58例(75%)は病理診断が不一致となり、臨床診断の難しさが強調されている6)。つまり、臨床診断がPDであっても病理では別の疾患であったり、病理診断でPDであるが臨床診断ではPDと診断できていない例が少なくない6、7)。
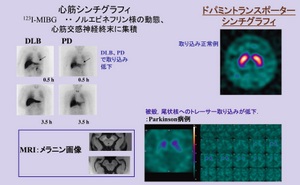
最近は、交感神経心筋シンチグラフィ(MIBGシンチ)8)や、ドパミントランスポーターシンチグラフィ(DATシンチ)9)、MRIなどを参考に、診断の確率が高くなってきている。たとえば、DATシンチにおいて、PDは、被殻や尾状核へのトレーサー(Iofulpane)取り込みが低下する。
DWIを含むMRIは、多系統萎縮症(MutipleSystem Atrophy: MSA)や進行性核上性麻痺(Progressive Supranuclear Plasy: PSP)の鑑別に、DATシンチは本態性振戦(EssentialTremor: ET) との鑑別に、MIBGシンチはAlzheimer病(AD)の鑑別に有用である。MDSによる診断レコメンデーションはレベルAで、画像診断はかなり期待されているといえる。ただしこれらがPDの初期段階での有用性など課題も残っている(図1)。
家族性Parkinson病PARK2の診断
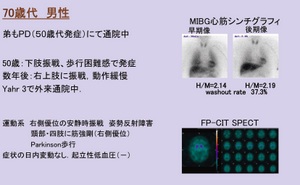
PARK2は、日本に多い家族性Parkinson病で、劣性遺伝である。図2の70歳代男性の例は、親が血族結婚であり、兄弟で発症した。MIBGシンチは正常だが、DATシンチでトレーサー取り込みが認められず、遺伝子検査で変異が確認され、PARK2と診断された。
2例目は、50歳代前半から徐々に運動症状を発症。MIBGシンチでは早期像、後期像ともに正常だが、DATシンチで取り込み低下が認められた。姉に振戦があり、調べたところ2つの異なる変異があり、それぞれが両親から受け継がれたものと考えられた。このように一見、孤発例に見えても家族性の場合がある。
3例目は、血族結婚もなく、家系内にPDもないがパーキン遺伝子に異常があり、患者は統合失調症の診断でずっと治療を受けていたが、夜間、睡眠時の行動異常がみられた。L-ドーパが奏功、DATシンチは非常に低下、MIBGシンチは早期像が正常で、後期像はやや低下した。
このようにPARK2では、通常のPDに比べMIBGシンチは多くで正常~軽度と報告されている8、10)。また、通常は早期発症で、典型例での診断法はそれほど難しくないが、行動異常から精神疾患と診断される例や特発性Parkinson病(iPD)のように自律神経障害が目立つタイプもある。非常に、バラエティに富んでいるが、Parkinson病全例に遺伝子検査を実施することは現実的ではなく、遺伝性が疑われる場合のほかに、臨床的に一見弧発性のPDに見えてもMIBGシンチやDATシンチで不釣合いな結果が出た場合に行うといった使い方が妥当ではないかと考える。
最近注目されているSWEDDs
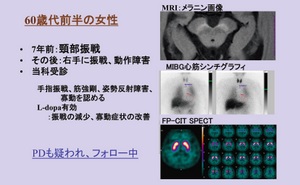
最近、臨床診断はPDであるが、DATシンチは正常となる、SWEDDs(Scans withoutevidence of dopaminergic deficits)が注目されている。これは、ET、ジストニア、薬剤性Parkinson症候群、血管性Parkinson症候群など鑑別が難しい例が混入しているためと考えられる。また、PD初期でのわずかなドパミン神経の異常をとらえきれず、数年後の追跡で、ドパミン神経の異常が確認できる場合もある、といった指摘もある9)。その場合、数年後の追跡によりドパミン欠乏が確認できることもある。図3は初期PDと考えられている例で、振戦、動作障害があり、診察時に筋強剛、姿勢反射障害、寡動が認められ、L-ドーパが有効であった。MIBGシンチは早期像が1.45、後期像が1.38で集積低下と判断できたが、DATシンチではドパミン異常が認められなかった。運動症状が出ている場合には、進行期になって判断できる例があることも考慮し、DATシンチで経過をフォローすることも行われる。
SWEDDs で話題となるのが、ジストニアである。一般の成人にみられるジストニアでは書痙、攣縮性斜頸、眼瞼攣縮などの症状があり、比較的頻度が多いが、遺伝性のジストニアの頻度は比較的少ない。これまで神経変性疾患の多くは特定疾患に指定されていたが、2015年、特定疾患の制度が難病法(難病の患者に対する医療等に関する法律)に変わり、指定難病が追加され、遺伝性ジストニアも指定された。
遺伝性ジストニアの中で、DYT5 ジストニアは、若年発症の歩行障害、日内変動があり、L-ドーパに非常によく反応する。若年性Parkinson病なのか、DYT5なのかが問題になる。指定難病に含まれるようにもなり、きちんとした診断が求められる。DYT5の場合、多くの例ではMIBGシンチも、DATシンチも正常である。若年発症であれば、DYT5ジストニアの可能性も考慮して検査を進める必要がある。
PDの前駆症状としてのレム期睡眠行動異常
PDは運動症状を基に診断されるが、運動症状が明確になる前の前駆症状をどうとらえるかが、最近大きな話題となっている。遺伝性の場合のリスクはあるが全く症状がないPre-Physiologicalな段階、臨床症状はないが、DATシンチ、MIBGシンチ、嗅覚検査などで異常を認めるPre-Clinical段階、嗅覚異常、便秘などの非運動症状が認められるが運動症状が出ていないPre-Motor段階、軽度の運動症状はあるがPDとして診断できるほどの強さではないPre-Diagnostic段階、運動症状を基にPDと診断される段階という流れがある11)。
非運動症状の1つが、レム期睡眠行動異常症(RBD)である。レム期には筋緊張抑制が生じるので動けない。ところがRBDの場合、筋緊張抑制が欠如しており動くことができ、隣にいるパートナーに突然殴りかかる、突然走り回る、非常に大きな声で騒ぐなど、夢に伴った異常行動を示す。脳波をとると、レム期であることが確認でき、RBDと診断される。これがPDの前駆症状の1つではないかと考えられている(表1)。
MIBGシンチでは、PDとRBDで同じように集積低下が認められた12)。DATシンチでも、RBD、PDで低下が認められ、RBDは対照とPDの中間あたりの値を示し、将来PDに移行するという考え方もある13)。MIBGシンチとDATシンチでのずれが、自律神経障害と運動症状の出方の差としても理解できる。運動症状によるPD診断前に、RBDをPDの前駆段階として治療介入の可能性も期待できる。
見逃されているLewy小体病
Lewy小体病(Lewy body disease: LBD)は、Lewy小体の存在を特徴とするすべての病態を包括する概念で、認知症症状が先に生じればLewy小体型認知症(Dementia with LewyBodies:DLB)、PDの運動症状が先にあり、その経過中に認知症症状が生じたら認知症を伴うParkinson病(PD with Dementia: PDD)となる。両者に本質的な違いがあるという証拠はない。DLBとPDDを、LBDという一連のスペクトラムの中で考えて、認知障害や運動障害の時間的な出現順序や程度の違い、すなわち同じ疾患の表現型のバリエーションとして理解できる。
DLBとADは、認知機能障害のパターン、幻覚の出方、RBDであるかどうかなど、所見の違いや検査結果の違いで鑑別できる。認知機能障害レベルが同様な場合、行動・心理症状(BPSD)はDLBの方が問題症状が多いとの指摘もあり14)、DLBの診断が重要である。ADで見られるような物盗られ妄想や、物の置き忘れを示し、遅れて徐々に運動障害が生じ、最終的にはDLBと考えられる症例も少なくないとの指摘もある。
PIB-PETによるアミロイドイメージングでは、アミロイド沈着はADに次いでDLBで高く、その次にPDDとなり、PDでは対照群と同程度であるとの報告もある15)。我々もADのマーカーである脳脊髄液(cerebrospinalfluid:CSF)の p-tau/Aβでは、DLBがADに近く、その次がPDDで、PDは対照群とあまり差がなかったことを認めている。アミロイドPETの陽性率を比較すると、PDD、PDMCI(PD-軽度認知障害)ではほとんど差は認められないが、DLBでは陽性率が高い16)。LBD患者に対して、アミロイドイメージング(PIB-PET)と、MRIを行ったところ、海馬傍回萎縮が強いのはPIB-PETが陽性でアミロイド病変がある例であったとする報告もある17)。LBDの中でもそのような病変が加わっている場合、萎縮を示しやすいことが報告されている。DLBにはAlzheimer病変が加わっている可能性があることが示唆される。
別の報告では、ADの病変を示さないDLBのほうが、コリンエステラーゼ阻害薬が有効であることが示されている18)。コリンエステラーゼ阻害薬はAD治療薬として使われている。PETによるアミロイドイメージングとともに、病態の反映も示されるようになってきて、アミロイド病変、タウ病変、あるいはLewy小体の構成タンパクであるシヌクレイン病変を評価し、将来予測、病態の把握をすることが今後期待される。
進行性核上性麻痺とPDの鑑別
Parkinson症候群の1つである進行性核上性麻痺(PSP)は眼球運動障害、易転倒性、筋強剛などを特徴とする疾患である。発症初期1、2年の段階で、これをPDとどう鑑別するかが課題となっている。
病理学的にPSPであっても、臨床症状が様々で、一番典型的なPSP の病像を呈するRichardson症候群(RS)はPSP全体の半分ほどで、PDの臨床所見を呈するPSP Parkinsonism(PSP-P)のほか、日本から報告されたPSP純粋無動症(PSPPAGF)、大脳質基底核変性症(CBD)の症状を呈するPSP(PSP-CBS)、進行性非流暢性失語(PNFA)を示すPSP-PNFA、前頭側頭葉型認知症(FTD)様の症状を示すPSP-FTD、小脳性運動失調を主体とするPSP-Cなど、臨床的に多岐に渡るため、診断が難しく、最終的には病理学的診断が必要とみなされている。
PSPでは原則として、MIBGシンチは正常で、DATシンチで取り込み低下が認められる。 PDとPSPの鑑別は非常に難しく、典型例は診断できるが、境界型は特に難しい。MRIは進行例では有用であるが、初期例の診断が難しい。今後、放射線画像診断の進歩、特に核医学やPETを用いたタウイメージングなどで病理学的変化が正確にとらえられるようになればと期待している。
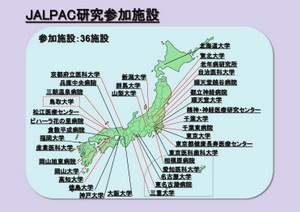
PSPやCBDなどでは、臨床診断をしても、病理学的診断で診断が変わる例も多い。現在、JALPAC(Japanese Longitudinal BiomarkerStudy in PSP and CBD)という全国多施設共同研究を行っている。臨床情報、生体試料、遺伝子試料を集め、可能ならば病理学的試料も含めて研究、診断、治療法の開発に向けて取り組んでいく活動である。神経萎縮疾患の診断における、今後の画像診断の更なる発展が期待される(図4)。
<文献>
1) Parkinson J:An essay on the shaking palsy.1817. J Neuropsychiatry Clin Neurosci 14(2):223-236,2002
2) Berardelli A et al:EFNS/MDS-ES recommendations for the diagnosis of Parkinson’s disease.Eur J Neurol 20(1):16-34,2013
3) Postuma RB et al:MDS clinical diagnostic criteria for Parkinson’s disease.Mov Disord 30(12):1591-1601,2015
4) Hughes AJ et al:Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinicopathological study of 100 cases. J Neurol Neurosurg Psychiatry 55(3):181-184,1992
5) Joutsa J et al:Diagnostic accuracy of parkinsonism syndromes by general neurologists. Parkinsonism Relat Disord 20(8):840-844,2014
6) Hughes AJ et al:The accuracy of diagnosis of parkinsonian syndromes in a specialist movement disorder service.Brain 125(Pt 4):861-870,2002
7) Hughes AJ et al:The accuracy of diagnosis of parkinsonian syndromes in a specialist movement disorder service.Brain 125(Pt 4):861-870,2002
8) 織茂智之:MIBG心筋シンチグラフィの現状.神経内科 82(2):173-181,2015
9) 日本核医学会:SWEDDs(Scans Without Evidence of Dopaminergic Deficit) イオフルパン診療ガイドライン,2014
10)Quattrone A et al:Myocardial 123metaiodobenzylguanidine uptake in genetic Parkinson’s disease.Mov Disord 23(1):21-27,2008
11) Siderowf A et al:Impaired olfaction and other prodromal features in the Parkinson At-Risk Syndrome Study.Mov Disord 27(3):406-412,2012
12) Miyamoto T et al:Reduced cardiac 123I-MIBG scintigraphy in idiopathic REM sleep behavior disorder.Neurology 26;67(12):2236-2238,2006
13) Kim YK et al:The implication of nigrostriatal dopaminergic degeneration in the pathogenesis of REM sleep behavior disorder.Eur J Neurol 17(3):487-492,2010
14) Bjoerke-Bertheussen J et al:Neuropsychiatric symptoms in mild dementia with lewy bodies and Alzheimer’s disease.Dement Geriatr Cogn Disord 34(1):1-6,2012
15) Edison P et al:Amyloid load in Parkinson’s disease dementia and Lewy body dementia measured with [11C]PIB positron emission tomography.J Neurol Neurosurg Psychiatry 79(12):1331-1338,2008
16) Petrou M et al:Amyloid deposition in Parkinson’s disease and cognitive impairment: a systematic review.Mov Disord 30(7):928-935,2015
17) Shimada H et al:β-Amyloid in Lewy body disease is related to Alzheimer’s disease-like atrophy.Mov Disord 28(2):169-175,2013
18) Graff-Radford J et al:Imaging and acetylcholinesterase inhibitor response in dementia with Lewy bodies.Brain 135(Pt 8):2470-2477,2012
(本記事は、RadFan2016年4月号からの転載です)